Liu, Y., Yang, R., Liu, X., et al. Hydrogen Sulfide Maintains Mesenchymal Stem Cell Function and Bone Homeostasis via Regulation of Ca2+ Channel Sulfhydration. Cell Stem Cell 15, 66-78 (2014).
* 212회 인용, Google Scholar 2023 Mar 16 검색 기준
* doi: 10.1016/j.stem.2014.03.005

이전 페이퍼 소개에서 말했듯, 인체에서 자연스럽게 생기는, 흔히 '해로운 기체'로 알려진 것이 세 가지 있다. NO (일산화질소), CO (일산화탄소), H₂S (황화수소). 독성이 있어서 많이 들이마시면 죽는다. 이런 기체가 인체에 자연스럽게 생기고, 또 각자의 기능이 있다는 점이 모순적으로 느껴질지도 모른다. 그러나 흔히 말하듯 약이 과하면 독이고 독을 순하게 쓰면 약이 되듯이 이들도 '과하지 않으면' 생리 활성을 유지하는 데에 도움이 된다고 생각하면 되겠다. 그렇다고 일부러 들이마시지는 말고...
*배경지식*
논문을 소개하기에 앞서 이 논문이 탄생한 배경을 간단히 짚고 넘어가자.
어떤 질병의 증상 중 homocysteine (Hcy)이라는 물질이 몸에 축적되는 현상을 '고호모시스테인혈증' 혹은 '호모시스테인뇨증'이라고도 한다. 전자는 피 속의 호모시스테인 농도가 높아졌다는 뜻이고 후자는 하다하다 그게 소변으로 걸러져나오기까지 했다는 의미다 (신장에서 혈액을 걸러서 노폐물을 소변으로 내보내니까). 이 물질은 본디 황(S)이 포함된 아미노산인 메티오닌을 시스테인으로 바꾸는 과정에서 일시적으로 등장한다. 아래 그림을 보자면, 정상적인 대사과정에서 호모시스테인은 비타민 B6, 그리고 CBS와 CSE라는 효소에 의해 시스테인으로 바뀐다. 메티오닌이나 시스테인은 일반적으로 사용되는 아미노산으로, 딱히 해롭지 않다. 그러나 호모시스테인은 큰 규모에서 보자면 심장병이나 동맥경화 등을 일으키고, 세포 규모에서 보자면 강력한 산화제로서 세포 내 물질을 파괴하는, 고농도로 발생해서는 안되는 분자이다.
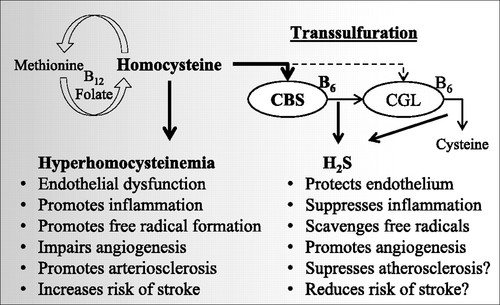
그런데 이 논문이 나오기 딱 10년 전, 2004년, The New England Journal of Medicine (엄청 잘 나가는 학술지다!)에 "호모시스테인 농도가 높은 사람은 뼈가 잘 부러진다"는 임상 조사 결과가 실린다 [DOI: 10.1056/NEJMoa032546]. 심장병에 관련된 이야기는 많았지만 호모시스테인이 뼈와 관련이 있다고? 골다공증이나 혈중 칼슘 농도(뼈가 칼슘 저장고 역할도 하니까)에 관련된 질병학자가 호모시스테인에 관심을 갖기 시작했다.

그런데 호모시스테인 자체를 파봐도 딱히 뭐가 나오진 않고... 이번에 소개할 논문의 성취는 여기에 있다.
"호모시스테인이 아니라, 거기서 한 단계 더 나아간 대사산물인 H₂S가 혹시 뭔가 하는 거 아니야?"
학계의 대세에 거스르는 의문을 제시하고 잘 증명해냈다는 점이 인상적인 논문이라 하겠다.
그렇다면 이제 논문의 주제는 뭐가 될까? 뼈와 관련된 이야기를 어떻게 풀어가야 할까? 저자들은 뼈를 만드는 세포, 즉 osteocyte (조골세포)에 집중하기로 한다. 척추동물의 몸에는 뼈를 만들며 칼슘을 저장하는 세포인 osteocyte와 뼈를 녹여 칼슘을 혈액으로 방출하는 osteoclast (파골세포)가 함꼐 일하고 있다. 이 친구들은 딱히 뼈를 튼튼하게 혹은 약하게 하려는 건 아니고, 어디까지나 '몸에 흐르는 액체 = 체액이나 혈액'의 칼슘 농도를 일정하게 유지하는 데에 더 관심이 많은 세포다. osteoclast도 나름 역할이 있으니 뼈를 녹여내는 세포라 해서 쓸모가 없는 건 아니다.
그런데 칼슘을 예금하는 놈과 출금하는 놈이 방향만 반대로일 뿐 비슷한 세포 아닌가 싶은 직감에 반하게도, 이 두 세포는 기원이 다르다. 물론 몸을 구성하는 모든 세포는 최초의 수정란 세포 하나에서 기원하지만서도... 일단 osteocyte는 '중간엽 줄기세포 mesenchymal stem cell'가 분화 및 성숙하면서 생겨난다. 이 다음에 설명할 '조혈모(줄기)세포 hematopoietic stem cell'와 마찬가지로 주로 골수에 존재하며, 인간 배아의 '중배엽'이라는 조직에서 기원한다. 중간엽 세포는 '표면 epitherial'을 구성하는 세포들과 달리 서로 느슨하게 연결되어있는 경향이 있고, 아메바처럼 이리저리 기어다니는 능력이 발달한 경향이 있다. 이 기어다니는 능력으로 조직을 뚫고 다른 조직에 칩입하기도 하는데, 이 얘기는 암세포를 다루는 다른 논문에서 자세히 애기하려고 한다.
아무튼 이 두 가지 줄기세포는 수정란이나 배아줄기세포처럼 모든 종류의 세포를 만들어내지는 못하고, 만들어낼 수 있는 종류가 제한된, 어느 정도 전문성을 띄는 줄기세포라 할 수 있다. 조혈모세포는 혈액에 있는 세포들로 분화하는데, 특이하게도 osteoclast도 만들어낸다.

여기서는 mesenchymal stem cell이 '뼈를 만드는' osteoblast, osteocyte의 기원이 되는 줄기세포라는 점만 확실히 기억하고 넘어가도록 하자.
**논문 해설**
저자들은 골수(bone marrow, BM)에 존재하는 중간엽줄기세포(BMMSC)가 osteoblast/cyte의 기원이라는 점과, H₂S를 연결지었다. BMMSC에 H₂S를 만드는 효소, CBS와 CDE가 존재할까? 그리고 그로부터 H₂S이 만들어질까?
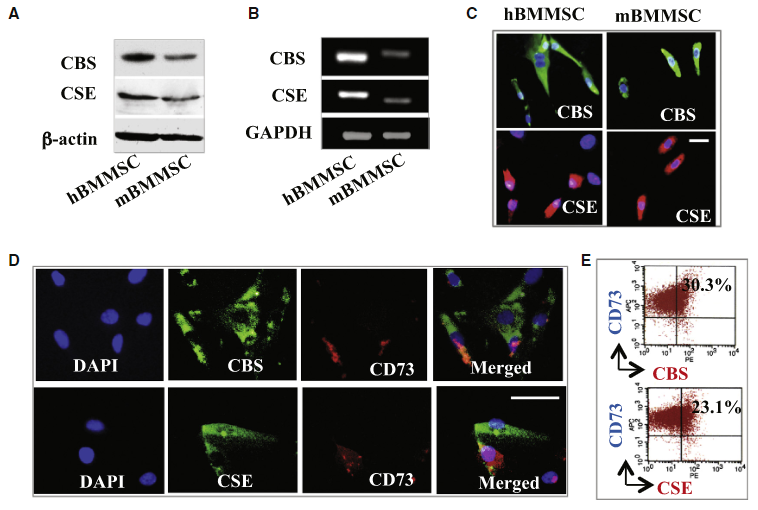
이 논문은 사람의 질병을 동물에서 재현하고 이 동물 모델로 후속 실험을 이어나갈 예정이기 때문에, 논문은 인간 골수에서 꺼내다 배양한 human BMMSC (hBMMSC)와 실험용 생쥐에서 추출해다 배양한 mouse BMMSC (mBMMSC)를 비교하는 그림으로 문을 연다. FIGURE 1A와 B는 각각 단백질의 발현과 mRNA의 발현을 살펴본 것인데, 생쥐의 세포가 사람의 경우보다 좀 약하긴 해도 CBS와 CSE가 발현하는 걸 볼 수 있다. 잊어버릴 즈음이라 다시 강조하자면 CBS와 CSE는 호모시스테인을 시스테인으로 바꾸고 마침내 H₂S를 만드는 일련의 효소 반응에 순차적으로 개입하는 효소이다.
FIGURE 1C-E는 생쥐의 BMMSC만 사용한다. CBS와 CSE에 각각 녹색 형광을 달아 세포의 어디에서 발현하는지, 그리고 전체 세포 중에 얼마나 많은 세포가 이 효소들을 발현하는지 살펴본 데이터이다. FIGURE 1E는 FACS라고 해서, FIGURE 1D 이미지에 나온 세포를 하나 하나 떼어다가 형광 신호를 측정한 데이터라고 볼 수 있다. CD73은 '이 세포가 중간엽줄기세포인지' 표지하는 단백질이고, 십자선의 윗 부분 두 칸에 속하는 점(=세포)이 중간엽 줄기세포란 뜻. CBS나 CSE를 발현하는 세포는 십자선의 오른쪽 칸에 해당하므로, '중간엽 줄기세포이면서 효소도 발현하는 세포'는 십자선의 오른쪽 윗 칸에 자리잡는다. 살펴보니 전체 중간엽 줄기세포 중 약 1/4 정도가 CBS나 CSE를 발현한다. 둘을 동시에 발현하는 세포는 따로 살펴보지 않았다. (그게 중요한 거 아니야?)
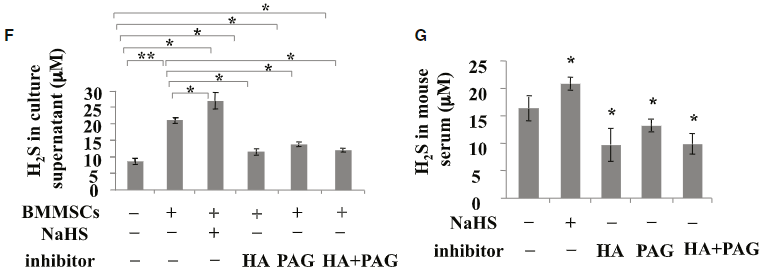
이 세포들은 H₂S를 만들어낼까? H₂S는 세포 밖으로 잘 흘러나오니까, 이 세포를 키운 배양액에 H₂S가 흘러나올 것이다. FIGURE 1F에서는 빈 접시에 배양액, 배양액에 BMMSC 세포 넣어서 키우기, 그리고 세포를 키울 때 황을 공급 (NaSH)하거나, CBS 효소의 활성 억제제 (HA), CSE 효소릐 활성 억제제 (PAG) 또는 둘 다 넣어 키우며 배양액으로 흘러나온 H₂S의 농도를 잰 데이터다. 빈 접시에 담은 배양액에 원래부터 있던 H₂S가 대충 10 μM의 농도이고, 세포를 키우면 H₂S가 증가한다. 황을 추가로 공급해서 키우면 당연히 더 늘어나고, CBS나 CSE 효소를 억제하면 원래 배양액에 있던 H₂S에 비해 크게 늘어나지 않는다. 특기할 점은 두 효소 중 하나만 억제한 경우와 두 개 모두 억제한 경우에 H₂S가 그다지 차이가 나지 않게 낮다는 점이다. 두 효소 모두 H₂S의 생성에 결정적인 역할을 하고, 둘 중 하나만 잃어도 H₂S는 생기지 않는다! 배경 지식 문단에서 보았듯 CBE의 대사산물을 CSE가 넘겨받아 시스테인 및 기타 부산물 (glutathione과 H₂S)을 만드니까, 앞 단계 하나만 막아도 뒷 단계는 발생할 수 없다. 오케이, 잘 들어맞는다.
오른쪽의 FIGURE 1G는 마찬가지로 황 공급원이나 효소 억제제를 먹인 생쥐의 혈액에서 H₂S 농도를 확인한 데이터로, 세포 실험과 일관된 결과를 보여준다.

FIGURE 2 A-C는 CBS 효소를 한 개 혹은 두 개 없애버린 실험쥐에서 진행된다. 포유류는 한 쌍의 연색체가 쌍으로 존재하므로 어떤 유전자를 없애고 (KO, 즉 knock-out이라고 한다.) 싶다면 양쪽 염색체를 모두 확인해야 한다. 하나만 없앤 경우를 '있다/없다'로 하여 +/-로 표기하고 둘 다 없앴다면 '없다/없다'로 하여 -/-로 표기한다.
CBS가 하나 혹은 두 개 모두 사라진 생쥐는 혈청에서 H₂S가 적게 검출된다 (FIGURE 2A). 이 생쥐들의 세포를 꺼내 배양해도 KO 돌연변이 세포는 배양액에서 H₂S이 적게 검출된다 (FIGURE 2B). 이들 돌연변이 생쥐는 정상 생쥐에 비해 골밀도도 낮다. 대퇴골을 잘라 골수에 칼슘이 자리한 부분과 세포가 자리한 부분의 면적을 비교하는 식으로 골밀도를 측정했다 (FIGURE 2C).

돌연변이 생쥐의 세포는 미미하지만 확실히 (FIGURE 2E, **) 정상 생쥐의 세포보다 세포 분열이 왕성하다. 세포 분열이 왕성하다는 것은 분화가 잘 일어나지 않는다는 뜻이다. 세포 분열을 하는 동안에는 유전자 복제 기구와 유전자 발현을 조절하는 단백질이 DNA에 붙기 위해 경쟁하고, DNA 복제 기구가 왕성하게 활동할 수록 유전자가 제대로 발현할 수 없기 때문에, 일반적인 '정상적인 세포'에서는 유전자 발현 패턴이 바뀌는 '분화'와 세포가 둘로 쪼개지는 '분열'이 동시에 일어나지 않는다. 암세포 같은 경우는 정상 세포보다 혼돈스러운 (chaotic) 양상을 띄어서 둘이 동시에 벌어지기도 한다만.
저자들은 여기서 "BMMSC 줄기세포가 H₂S가 부족할 경우 분화하기보다 분열한다"는 메세지를 던지고자 한 것 같다.
또한 이들 돌연변이, H₂S를 적게 만드는 BMMSC 세포는 칼슘 덩어리를 만드는, 즉 뼈를 만드는 기능도 현저히 떨어진다. 동그라미 안에 빨간 변적이 칼슘 염을 나타내는데, 정상 BMMSC가 (아마도) osteoblast, osteocyte로 분화하여 뼈를 만드는 것도 대조적으로 돌연변이 생쥐의 세포는 빨간 면적이 적다. 분화능력이 떨어지는 만큼 BMMSC가 osteocyte로 분화하지 않았을 것이고, 조골 = 뼈 형성 능력도 상대적으로 떨어질 것이다. Runx2와 ALP는 BMMSC가 osteoblast로 분화하는 동안 발현이 증가하는 단백질인데, 이들 단백질의 발현도 돌연변이 세포에서는 감소하였다 (FIGURE 2F).

그렇다면 돌연변이 세포에 H₂S를 공급하면? 세포의 칼슘 축적 기능이 회복되고 (rescued), 생쥐의 피하에 주사했을 시 (subcutaneous) 뼈 비슷한 것을 형성하는 것을 보인다. FIGURE 2가 loss-of-function 즉 기능 상실 효과를 보였다면 이 실험은 gain-of-function, 즉 기능을 도입했을 때의 반응을 보여준다. 이렇게 LOF와 GOF가 대칭적으로 완벽하게 들어맞는 검증은 생물학 실험에서는 좀처럼 보기 어렵기 때문에, 참 좋은 데이터라고 볼 수 있다.

여기서 잠시 저자의 가설을 다시 떠올려보자. 저자들의 주장의 핵심은 고호모시스테인증을 앓는 환자에게서 골형성능이 감소하는 패턴이 드러나는 이유는 호모시스테인 자체가 아니라 그 후속 화학 반응의 부산물인 H₂S가 부족해지기 때문이라는 것임을 기억하는가? 여기에서 돌연변이 세포에 H₂S를 공급하는 NaHS 대신 호모시스테인 (Hcy)을 처리해도 기능이 회복될까? 세포는 분열능이 감소하고 분화능을 회복할 것인가? 그렇지 않다! 위 막대 그래프에서 보듯, Hcy를 H₂S으로 바꾸는 능력이 없는 세포는 Hcy를 아무리 넣어주어도 분화하기 보다는 분열하며, 골 형성능도 20%에서 회복하지 못한다 (FIGURE S5 O, P).
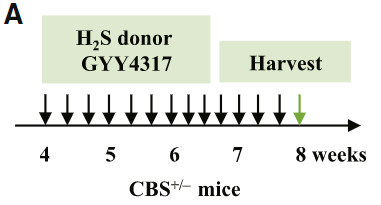
좋아, 다시 생쥐 실험으로 돌아가자. 그나저나 왜 여기서 갑자기 FIGURE 4에서 황 공급원을 NaSH에서 GYY4317이라는 물질로 바꾼 거지? Chemical 판매 사이트에서 GYY4317 항목을 찾아보니, slow relasing agent.. NaSH에 비해 천천히 체내 황 공급을 증가 시키는, 장시간 쥐에게 먹일 수 있는 상대적으로 순한(?) 약물인 듯하다.

앞서 말한 것과 동일하다. CBS를 상실한 생쥐는 H₂S의 공급에 의해 골 형성능을 회복한다 (FIGURE 4).

반대로 정상 생쥐에 CBS 효소의 기능을 방해하는 억제제를 먹이면 CBS 단백질이 줄어들 뿐더러 (FIGURE 5C) 혈액의 H₂S 농도가 떨어지고 골밀도도 감소한다 (FIGURE 5B, D). FIGURE 4와 대칭을 이루는 결과라 할 수 있다. 아까도 강조했지만 LOF과 GOF의 대칭은 참 아름답구먼....
정리하자면 논문 1장의 메세지는 "골수의 줄기세포는 H₂S를 만들고 osteocyte로 분화하여 뼈를 만든다. H₂S가 부족하면 그 반응이 일어나지 못한다."가 되겠다.
자, 이제부터 이 논문의 2장이다. 2장의 질문은 "H₂S가 중요하단 건 알겠어. 근데 그래서 H₂S에 의해 세포에 '무슨 과정'이 일어나서 그런 결과가 나오는데?" 이다. 이런 얘기를 하는 파트를 보통 '메커니즘 규명'이라고 한다.

칼슘에 관련된 세포이니까 칼슘을 한번 살펴보자. 정상 생쥐의 BMMSM는 H₂S 생산을 촉진하는 NaHS의 처리에 의해 세포 안으로 칼슘이 쏟아져들어온다 (FIGURE 6A, B). 그런데 칼슘 채널 중에 Cys 즉 –SH기가 많은 TRP 채널이라는 녀석들이 있다. TRP 채널 중에서도 전부는 아니고 V6, V3, M4 세 가지가 특히 Cys 시스테인함유 량이 높다.
그 세 가지 채널의 발현을 저해하면 H₂S의 증가에 의한 칼슘 유입이 줄어들 것인가? siRNA 라는 테크닉으로 이 채널들을 감소시켜보자. 아까처럼 KO 하지 않은 이유는 이걸 완전히 없애버리면 세포가 죽어버리기도 하고, 유전자 발현이 감소하기 전후를 연속적으로 볼 수 없기 때문에 유전자 발현을 일시적으로 감소시킨 것이다. 이런 테크닉을 knock down이라고 한다. TRP family 중 세 가지의 발현이 감소한 세포는 H₂S 농도가 증가했을 칼슘 유입이 정상세포에 비해 줄어든다 (FIGURE 6C).
이 채널의 시스테인 기와 칼슘 이온 유입은 무슨 상관이 있지? 정상 생쥐의 세포막에는 –S-SH 구조가 많다. 반대로 H₂S 생산이 감소한 돌연변이는 –S-SH 기가 적다 (FIGURE 6D). 아무래도 –SH기가 많을 것이다. 이번에는 칼슘 채널이 세포막의 안과 바깥 어디에서 H₂S와 반응하는지 보고자 한다. NaHS 처리를 하기 전에 세포에 미리 –SH기를 늘려둔 경우 (DTT), 세포 안팍의 –SH기에 미리 들러붙어 –S-SH기가 만들어지지 못하게 막은 경우 (DM), 세포 안에 파고들 수 없는 화합물로서 마찬가지로 세포 바깥에 노출되 단백질의 –SH기에 미리 들러붙어 –S-SH기가 만들어지지 못하게 막은 경우 (MTSES) 세 가지를 보자. 미리 –SH기를 늘려둔 경우 NaHS의 처리로 대부분의 –SH기가 –S-SH 형태로 바뀌었을 것이다. 이때는 칼슘 유입이 정상 세포보다 크게 증가한다 (FIGURE 6E, F). 반대로 –S-SH가 형성되지 못하게 막아버리면 칼슘이 유입되는 경로가 막힌다. DM이 더 강력하긴 하지만 MTSES 처리에서도 충분히 칼슘 유입이 막힌다. 정작 –S-SH기의 감소 폭은 MTSES에서 그렇게 크지 않은데도! 즉, 세포 바깥에 노출된 시스테인의 –S-SH 화 (sulfhydration) 이 결정적인 역할을 한다는 뜻이 아닐까?

아, 그런데 이 사람들이 TRP 채널 중에 V6, V3, M4가 중요한지는 어떻게 알아냈냐면... 논문 본문에서는 시스테인이 많은 채널들이라서 골랐다고 했지만 사실 TRP family 전부에 대해 하나씩 실험을 했다. 하나 씩 KD 했을 때 못 찾았거든... 그러니 냅다 제일 효과 좋아보이는 세 가지를 한꺼번에 KD 하기로 결심한 것이다. 저 노가다를 담당했을 대학원생의 눈물이 느껴진다.

앞선 FIGURE 6A-F가 좀 어려웠을텐데, 이번엔 좀더 직접적으로 –SH기와 –S-SH기로 표지된 TRP 단백질, 특히 TRP V6의 sulfhydration과 H₂S의 연관성을 보자.

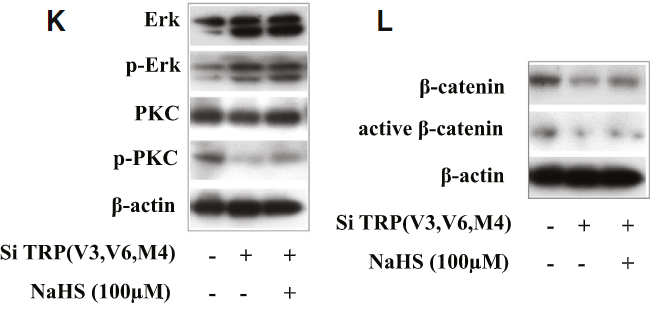
이제 일어나야 할 칼슘 유입이 일어나지 않아서 BMMSC의 성질이 변하는 것 같다는 단서를 찾았다. 그래서 저자들은 칼슘에 관련된 알려진 세 가지 신호 전달 체계를 선정했고, 실험 결과 PKC/ERK 신호 전달 체계가 반응을 보여서 그걸로 실험을 이어가기로 한다. 이 PKC/ERK 신호 전달 체계는 단독으로 검색하면 잘 안 나오고(...) protein kinase C = PKC가 칼슘 이온에 의해 활성화 되어 MAP/ERK 신호 전달 체계에 간섭하는 신호 전달 경로를 말한다.

세포 내에는 'calmodulin = 칼모듈린 = CaM' 이라고 하는 단백질이 존재한다. 이 단백질은 세포 안에서는 소포체(ER)에서 흘러나오는 칼슘, 혹은 이번 논문에서처럼 채널 단백질이 열리며 외부에서 유입되어 들어온 칼슘에 결합하여 구조가 바뀐다.

칼슘 이온 고농도 상태에서 우측처럼 길쭈–욱하게 바뀐 칼모듈린은 PKC 단백질에 직접 결합해서, 혹은 다른 단백질을 자극해서 간접적으로 PKC가 인산화되게끔 유도한다. 예를들어 Neurogranin (Ng = RC3 = p17 = BICKS) 이라는 단백질은 신경 세포에서 발현하는데, 칼슘이 없는 상태의 칼모듈린과 결합해 Ng/CaM 복합체를 형성하다가, 칼슘 농도가 높아지면 칼모듈린이 변형되면서 분리된다. 이렇게 풀려난 Neurogranin은 PKC에 의해 인산화되어 활성을 띄고 또 다른 신호 전달 체계를 거쳐 PKC를 인산화한다.
지금 논문에서 보고 있는 골수 줄기세포의 경우 세포에 칼슘이 쏟아져들어오면 PKC가 모종의 이유로 인산화되고 (p-PKC), 이 p-PKC가 ERK 라는 단백질의 기능을 저해한다. p-ERK 상태에서 화성을 띄는 ERK는 원래 세포질에서 인산화한 다음 세포 핵 내부로 이동해서 세포의 분열을 촉진하는데, 정상적인 BMMSC이라면 p-PKC가 p-ERK를 막아서고 있으니 분열능이 떨어진다. FIGURE 7C는 PKC와 p-PKC가 충분할 때 ERK 저해제를 처리하면 'p-ERK만' 단백질 양이 줄어드는 걸 보여주는데, 이 말인 즉 ERK가 PKC 보다 하단(downsteam)에서 작동한다는 점을 시사한다.
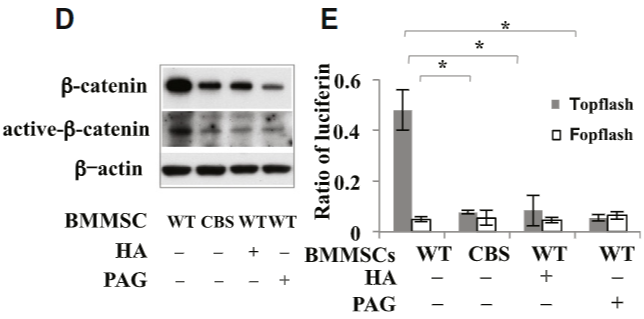
메커니즘 부분은 데이터 설명하기가 복잡하네... 그런데 앞에서 PKC는 '모종의 이유로' 활성화된다고 했다. 왜냐하면 골수 줄기세포에서는 칼슘 이온 자체가 직접 PKC에 영향을 주기 보다는 '일반적으로' PKC를 인산화해주는 다른 신호 경로가 활성화되어있기 때문에, 이 신호 경로의 영향력이 훨씬 강하기 때문이다. 줄기세포 생물학이나 암 생물학에서 엄청 자주 보이는 신호 전달 경로인데, 바로 β-catenin/Wnt 신호 전달 경로이다. CBS가 없는 돌연변이 세포나 CBS 저해제를 처리한 세포처럼 세포 내외부의 H₂S 농도가 낮은 경우 세포는 β-catenin 이라는 세포 외 신호 전달 단백질을 적게 만들어낸다 (FIGURE 7D). 본디 β-catenin이 세포 밖으로 분비되어 다시금 주변 세포의 신호 수용체에 달라 붙어 Wnt 라는 단백질의 발현을 유도해야 하는데, β-catenin의 발현이 줄어들자 β-catenin 신호 전달 하단에서 반응하는 모든 단백질의 반응이 줄어든다 (FIGURE 7E). β-catenin 단백질에 유도되는 반응의 크기를 보는 실험이 Topflash/Fopflash인데 다음에 기회가 되면 설명하도록 하자.

결과적으로 저자들은 칼슘 유입에 따라오는 β-catenin/Wnt 그리고 PKC/ERK 신호 전달 체계가 맞물려 BMMSC의 분화능을 유지하고 있고, CBS/CSE의 돌연변이나 저해에 의해 세포 내 H₂S의 생산이 감소할 경우 TRP 칼슘 채널의 기능이 떨어지면서 BMMSC 세포가 osteoblast/osteocyte로 분화하지 못할 때 골 형성능이 감소함을 보였다 (FIGURE 7H-L).
메커니즘 파트가 상당히 복잡하고, 특히 이 파트는 논문에 따라 어떤 조직에 특성화된 세포를 기준으로 했느냐에 따라 서로 상충되는 설명도 보이곤 하기 때문에, 상당히 까다롭다고 생각하며 읽었다... 논문 외부에서 습득한 지식과 잘 맞는냐는 둘 째치고 이 논문에 한정지어서 볼 때는 설명들이 잘 맞물리는 느낌이라 완성도가 높은 논문이라고 생각하긴 한다.
H₂S와 세포 내 칼슘 유입을 연결짓는 파트가 굉장히 스마트하다고 생각했는데, 원래부터가 임상 질병 연구에서 고호모시스테인혈증 환자와 골다공증/골절의 상관관계를 보고했기 때문에 그를 배경으로 나온 논문이라 약간 실망했달지, 어떤 면에서는 반대로 감탄했달지...
(+)

CBS 효소를 KO한 생쥐는 보다시피 일단 뼈가 잘 만들어지지 않을테니 덩치도 작고 약간 기형적이라 해야하나, 잘 자라지 못한다 (FIGURE S2A). 최초로 CBS KO 생쥐를 만들었던 다른 실험 그룹의 보고에 따르면 이 생쥐는 잘 자라지도 못할 뿐더러 심장병에 유난히 취약하다는 얘기도 있는데, H₂S가 골수 줄기세포의 분화 뿐 아니라 심혈관계 조절 기능도 있음이 이 생쥐로부터 발견되기도 했다.
덧붙여 CBS KO 생쥐의 BMMSC이 지방 세포로 분화하는 건 확인되어서, 이 분화 경로는 H₂S 와 상관 없는 듯하다는 게 또 다른 곁다리 이야기 (FIGURE S2C).
***실험 기법***
논문 본문에서는 quantitative micro CT (생쥐 뼈도 촬영 가능할 만큼 정밀한 X-ray 단층 촬영인데 데이터 정량도 해준다.)도 찍고 이런저런 실험이 나오지만 나는 생화학 기법만 살펴보고 패스~
1. BrdU Assay
BrdU는 Br (브롬)으로 특별히 표지된 우라실 기를 말한다. 세포가 DNA를 복제할 때에 thymine (티민, T) 대신 끼어들어가 염색한다. 둘 다 피리미딘계 염기로 구조가 비슷하기 때문에 가능한 일! DNA에 끼어들어가기 때문에 염기는 우라실 기이지만 당 부분은 디옥시리보오스 형태를 띄고 있다.
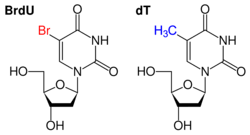
복제가 일어나는 세포 주기는 S기이다.

따라서 BrdU Assay는 S기를 거친 세포에서 반응성이 높아지게 된다. 따라서 세포의 분열 (proliferation)이 활발한 세포일 수록 반응이 강하다.
2. Alizarin Red S Staining
Alizarin red S 는 세포 내 칼슘 Ca²⁺ 이온과 반응한다. 정확하게 칼슘만 저격하는 건 아니고, 마그네슘, 망간, 바륨, 스트론튬, 철 이온과도 반응하여 붉은 색을 보인다 (한 마디로 2가 금속 이온과 결합할 수 있다고 생각하면 편하다.).
실험 방법을 요약하자면: 2% Alizarin Red S 수용액을 준비하고, 세포를 10% formalin (혹은 37% formaldehyde)로 고정한 후, 칼슘이나 망간이 없는 세포 등장액 (DPBS w/o Ca²⁺, Mg²⁺)으로 배양액을 잘 닦아내고, 세포 층이 Alizarin Red S 용액에 골고루 잠기게끔 용액을 넣어주어, 실온의 어두운 곳에서 45분 간 방치하면 된다. 염료이기 때문에 깨끗한 결과를 얻으려면 DPBS로 5번 정도 Alizarin Red S 용액을 씻어내야 한다.
결과는 짜잔, 금속 이온 염이 침작된 부위가 빨갛게 물든다! 현미경 사진도 괜찮고 빨강색 빛을 쐬어 반사도/흡광도를 찍기도 한다.
3. Oil Red O Staining
한국 교육과정 상 중학생 때 즈음으로 기억하는데, 3대 영양소 탄/단/지 검출 실험으로
- 탄수화물: 베네딕트 반응, 은거울 반응, 요오드 염색법 (녹말)
- 단백질: 뷰렛 반응, 크산토프로테인 반응
- 지방: 수단 III 염색법
을 배웠다. 이 중에 요오드나 수단 III '염색'법은 다른 검출 반응과 달리 화학 반응이 일어나는 방식이 아니다. 수단 III 염색의 결과는 '지방이 붉게 물든다'는 것인데, 그 이유는 단순히 수단 III가 지용성 성분이라 지방에 더 잘 용해되기 때문이다.본래 물에 녹여둔 수단 III가 지방, 지질 성분과 섞일 경우 '더 녹기 쉬운 쪽' 용매로 옮겨가는 것이다.
Oil Red O 염색법도 기본적인 원리가 같다. 애초에 Oil Red O가 수단 III를 포함하는 다양한 Sudan (수단) 염료 계열에 속하기도 하고...
지방 세포처럼 세포 내부에 기름이 든 액포가 존재한다면 Oil Red O 염료를 처리했을 때 세포에 빨갛게 액포가 표시된다. 염료 자체가 지용성이라 세포막의 인지질이중층 막을 통과하기도 용이하다. 수용성 염료의 경우, 바로 위에 적은 Alizarin Red S Staining 에서 보듯, 세포를 고정하고 막을 터뜨려서 내부로 침투시켜야 하는 경우도 있는데, 비교적 간편한 실험.
4. Maleimide Fluorescence Assay
아래 그림 Maleimide Fluorescence Assay 의 개요이다. Maleimide는 고리형 유기화합물로, pH 6.5-7.5의 중성 환경에서 이중결합이 풀리며 –SH 기와 결합하는 특징이 있다. 염기성 환경으로 갈수록 –NH₂ 기와 결합하기를 선호하는 것도 또 다른 특징이다. 이 특징을 이용하면 Maleimide에 각종 형광물질이나 염색 시약을 붙어 –SH 기에 표지를 붙일 수 있다. 그런 식으로 Maleimide에 초록 형광 염료 분자를 붙인 것이 논문에서 말하는 green maleimide.

Maleimide 자체의 흡광도를 활용해도 되지만 좀더 signal 이 강한 물질을 따로 붙여서 이용하는 게 트랜드인 듯~.
'논문 정리 > 기타 흥미로운 논문' 카테고리의 다른 글
| [2006 Nature] S-Nitrosylated protein-disulphide isomerase links protein misfolding to neurodegeneration (3) | 2023.03.10 |
|---|